【特別講義 第22回】iPS細胞から膵島の大量培養法の開発
講師は第21回に引き続き、国立国際医療研究センターの大河内仁志先生です。前回は、「今なぜiPS細胞から膵島作製が必要なのか?」というテーマで背景から作製した細胞のマウスにおける性能評価までのエピソードをご紹介いただきました。
今回は、実際の臨床応用を見据え、iPS細胞から膵島を大量に作製する培養法の開発から、さらなるスケールアップの検討やその課題点についてご寄稿いただきました。
基礎研究から臨床応用へ向けた培養法やそのスケールアップは、単純にはいかないものですよね。ご苦労されている研究者の方も多いのではないでしょうか。ご共感いただける内容もあるかと思いますので、ぜひお楽しみくださいませ。
■ 講師紹介ページ: 国立国際医療研究センター 大河内 仁志 先生
■ 第21回 今なぜiPS細胞から膵島作製が必要なのか?
“iPS細胞から膵島の大量培養法の開発 “
国立国際医療研究センター
細胞組織再生医学研究部 部長
大河内 仁志 先生
1型糖尿病患者へiPS細胞から誘導した膵島を移植する場合に、治療効果を期待するには大量の細胞が必要になる。マウス(体重25g)で必要な膵島の量を1として体重比で換算すると、ヒトでは2000倍以上の量が必要になる。
接着培養では培養皿の大きさに制限があるので、数百枚もの培養皿を処理しなければならない計算になる。そこでスケールアップが容易な浮遊培養法の検討を行った。
浮遊培養法
浮遊培養法として球状の細胞凝集塊(spheroid)を作製するのが一般的である。まず未分化な状態でiPS細胞のspheroidを作製した。培養液を揺らさないとspheroidが沈殿して、大きな塊となってしまう。
そこで、浮遊培養法には培養容器全体を動かす旋回培養と容器内で羽根を回転させる攪拌培養とがあるので、両方試した。旋回培養ではどうしてもspheroidが中央に集まってしまう傾向が見られた。
下図のように、エイブル社のバイオリアクターを用いて攪拌培養を行うと、比較的均一なspheroidが得られた。羽根の回転数を調節して、spheroidの大きさを変えることができるが、spheroidが大きくなると内部の細胞が死んでしまう。本物の膵島の大きさに近い直径150 -250μm程度にする条件を見出した(下図 文献2より引用。scale bar = 200μm)。

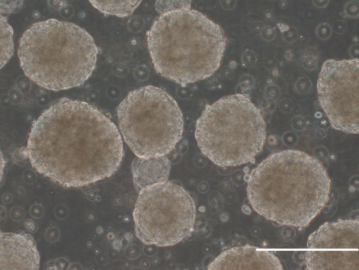
次に、spheroidの状態で膵島細胞を分化させる条件を検討をした。接着培養では分化の第1段階である原始内胚葉(Definitive Endoderm)が重要であったので、接着培養と同じプロトコールで浮遊培養を行って、経時的に遺伝子発現を比較した。浮遊培養の方が24時間程度早く、原始内胚葉の遺伝子が発現することを見出した(文献1)。羽根の回転数や添加する因子を調整しながら、浮遊培養のプロトコールを改良した。
30ml 用の容器を用いて、3×10の7乗個の細胞から分化を開始すると、途中で細胞が増殖して、最終的に5-6×10の7乗個の細胞を得ることができた。細胞密度に関して、接着培養では2×10の5乗個/ml程度の培養しかできなかったが、この浮遊培養系では、その10倍の2×10の6乗個/mlの高密度培養が可能になった。
マウスへの移植実験
iPS細胞から膵島まで分化させたspheroidは免疫染色の結果により、3-4割がインスリン産生細胞であった。前回述べたように免疫不全の糖尿病モデルマウスを作製して、片方の腎臓の被膜下に6×10の6乗個の細胞を移植した。今回は移植した全てのマウスにおいて、移植3-4週間後から随時血糖値の降下が見られた(下図、文献2の図を改変)。
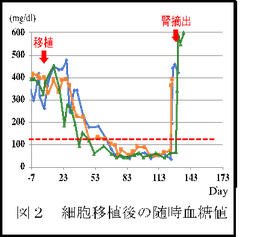
以前に、接着培養の最後の段階で作製したspheroidよりも、良い結果が得られた。移植前のインスリン分泌能は同程度であり、移植方法も同じなので、最初から浮遊培養したspheroidは物理的により“丈夫”になって、腎臓での生着率が向上したと考えた。
特筆すべきは、移植して8週後に随時血糖値が100mg/dl未満になったことである。マウスの正常血糖値は120-150mg/dlと言われている(図2の破線)。移植した膵島細胞はマウスの体内においても、ヒトの正常血糖値の設定になっていることが示唆された。また細胞移植をした腎臓だけを摘出すると、血糖値がすぐに上昇した。移植した膵島細胞が血糖値を下げていたことを証明できた。
ES細胞やiPS細胞由来の細胞移植実験において、糖尿病モデル動物で、これほどしっかりと血糖値をコントロールできたという報告は、世界的に見ても少ないと、密かに自負している。
また移植したマウスに砂糖水を飲ませて、糖負荷試験を行うと、一時的に血糖値は上昇したが、速やかに血糖値は正常化した。機能的にも本物に近い膵島ができたと考えられる。さらに細胞移植した腎臓の組織を解析すると、ヒトα細胞やβ細胞以外にソマトスタチンを産生するδ細胞も存在していることが判明した。構成細胞の点からも本物の膵島に近いと言える。
臨床応用に向けた培養スケール
さて、マウスの1型糖尿病を6×10の6乗個の細胞を移植して治すことができた。前述したように体重比で、ヒトはマウスの2000倍として計算すると、ヒトの治療には1.2×10の10乗個の細胞が必要となる。
30mlの培養で6×10の7乗個の細胞を得られるので、単純計算で6Lの培養が必要となる。30mlの容器だと200個必要である。理論上は3Lの容器を使えば2個、あるいは1Lの容器を使えば6個で、必要細胞数を確保できる。
しかし話はそう簡単ではない。我々は現在100mlの容器を使用して、スケールアップをしている。回転数などの30mlの培養条件が、必ずしも100mlの容器に当てはまらないことが判明した。30mlと100mlでの違いを明らかにして最適化できると、500mlや1Lの容器へのスケールアップの際に役立つはずである。時間はかかるが、ステップバイステップでのスケールアップが現実的な対応になると考えている。
iPS細胞から誘導した膵島細胞の機能については、ある程度使える目処がついたと思われるが、まだ本物のβ細胞のレベルには到達していない。さらに機能を向上させられれば、移植に必要な細胞数を減らすことができる。次回は臨床応用に向けて、さらなる問題点について述べたい。
参考文献
1. Yabe SG et al. Human iPS-derived spheroids in suspension culture express developmental stage specific genes toward definitive endoderm differentiation earlier than adherent cells. Int J Dev Biol 2019;63(6-7):271-280.
2. Yabe SG et al. Induction of functional islet-like cells from human iPS cells by suspension culture. Regen Ther. 2019, 10:69-76
当社Facebookページをフォローしていただきますと、Kyokutoブログ等の情報をいち早く入手できます。こちらもどうぞご覧ください。
今後読みたい内容等ありましたら、以下のお問合せより、ご意見・ご要望いただけましたら幸いです。
フォームが表示されるまでしばらくお待ち下さい。
恐れ入りますが、しばらくお待ちいただいてもフォームが表示されない場合は、こちらまでお問い合わせください。
